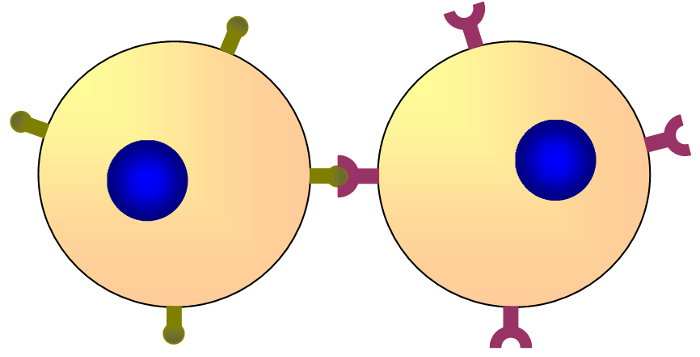
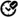Índice de este artículo

Las macromoléculas orgánicas son compuestos de gran importancia para los seres vivos, cumplen diversidad de funciones necesarias para la vida. Una de las más importantes son las proteínas, biomoléculas de gran tamaño cuyo trabajo es esencial para el funcionamiento del organismo. Forman parte de todas las células, tanto de seres unicelulares como pluricelulares.
Las proteínas están compuestas por péptidos de aminoácidos y poseen una estructura compleja, su síntesis se realiza durante el proceso de traducción celular. Más adelante encontraras información detallada sobre que son estas macromolécula, sus funciones, su conformación, tipos y cuáles son las fuentes alimenticias que proveen el mayor aporte de esta biomolécula esencial.
¿Qué son las proteínas?
Son moléculas biológicas de gran tamaño (macromoléculas), están constituidas por la unión de varios cientos a miles de aminoácidos. En su estructura podemos encontrar elementos como carbono, hidrógeno, oxígeno y nitrógeno, además pueden combinarse con otros elementos como azufre, hierro, fósforo, entre otros.
La unión de los aminoácidos para la conformación de las proteínas se da a través de enlaces peptídicos, a medida que se forma la cadena de aminoácidos reciben varios nombres (oligopéptido si es menor de 10 aminoácidos, polipéptido para mayores de 10). A menudo polipéptido se suele usar para nombrar a las proteínas.
La síntesis de proteínas se realiza durante el proceso de traducción, siendo el resultado de la expresión del código genético. Las moléculas de proteínas no son estructuras lineales, sino más bien estructuras complejas que tienen plegamientos tridimensionales que les confieren diversidad de funciones.
Funciones de las proteínas
Esta increíble macromolécula tiene gran versatilidad, está presente en casi todas las estructuras que conforman los organismos vivos, además son vitales en varios procesos fisiológicos y metabólicos. Las funciones más importantes son las siguientes:
Estructural: al estar presente en todas las células, forman parte de las estructuras de sostén, resistencia y elasticidad de los tejidos y órganos de los seres vivos. Están presentes en las membranas plasmáticas de las células. Ejemplos son la queratina de la piel y el colágeno del cabello y los huesos.
Enzimática: función de gran importancia, son las encargadas de interaccionar con diferentes moléculas y sustratos, con la finalidad de acelerar los procesos metabólicos. Las proteínas que ejercen acción enzimática son muy diversas y a la vez específicas para cada sustrato, su nombre se deriva de las reacciones que catalizan. Ejemplo de ellas son las proteasas, actúan rompiendo las proteínas en moléculas más simples, la nucleasas degrada los ácidos nucleicos al final del su ciclo de vida.
Hormonal: realizan función reguladora, ejemplos claros de algunas proteínas que cumplen esta función son el glucagón y la insulina, que regulan la cantidad de glucosa en la sangre.
Defensa: también llamada inmunológica, actúan eliminando o inactivando cuerpos y sustancias extrañas (antígenos). Para ellos se emplean anticuerpos que son glicoproteínas.
Movimiento: forman parte esencial de la locomoción del cuerpo, gracias a ellas los músculos se contraen permitiendo el desplazamiento. La actina y la miosina son las proteínas encargadas de realizar esta acción.
Otras funciones no menos importantes son de transporte, de reconocimiento de señales químicas que incluyen receptores para diversas moléculas, transducción o modificación de señales y función de reserva.
Estructura de las proteínas
Actualmente se han descrito cuatro niveles de estructuración, las cuales siguen un orden de complejidad de acuerdo a su nivel de plegamiento. La conformación final de cada una de estas macromolécula tiene una influencia directa sobre la función que cumple en el organismo.
Estructura primaria de la proteína
Es la conformación más sencilla, se trata solamente de la secuencia y el orden en que los aminoácidos que la conforman se encuentran enlazados. Las posibilidades de combinación de los aminoácidos son realmente grandes, por lo que conocer la estructura primaria permite identificar posibles anomalías genéticas. Si se detecta al menos un cambio en la secuencia de aminoácidos, es posible que la proteína ya no sea funcional.
Estructura secundaria
En la estructura secundaria se observan los primeros plegamientos entre las cadenas polipeptídicas que conforman una proteína, este plegamiento sucede por la formación de puentes de hidrógeno entre aminoácidos que conforman la secuencia. Dependiendo del plegamiento que formen los aminoácidos se reconocen dos estructuras secundarias llamadas hélice alfa y hoja β-plisada. En esta estructura los enlaces se forman solo entre los grupos aminos (N-H) y el grupo carboxilo (C=O).
Estructura terciaria
Es un nivel más avanzado de plegamiento, se observa la forma tridimensional de la proteína necesaria para darle una función específica. En ella intervienen todos los grupos funcionales que conforman el cuerpo de la proteína; grupo amino, carboxilo y radical. Con la incorporación del grupo radical (R) se forman nuevos enlaces entre las moléculas, que incluyen puentes de hidrógeno, enlaces iónicos, interacciones hidrofóbicas, enlaces covalentes como los enlaces disulfuro.
Estructura cuaternaria
La conformación final o cuaternaria sucede cuando varias cadenas o subunidades de proteínas interaccionan entre sí, ensamblando proteínas complejas y de mayor tamaño. Para lograr unirse e interaccionar utilizan los mismos enlaces que la estructura terciaria.
Tipos de proteínas
Hasta el momento no existe una clasificación unitaria, sino más bien que atiende a varios aspectos. En nuestro caso utilizaremos la clasificación más universal que implica la estructura química.
Holoproteínas o simples: llevan este nombre ya que su estructura se conforma por solo la secuencia de aminoácidos. En esta clase se diferencian dos tipos que son: proteínas globulares y proteínas fibrosas. Ejemplo de las globulares son la gluteína, las albúminas y algunas hormonas como la insulina y la prolactina, por su parte, en las fibrosas encontramos a los colágenos y queratinas.
Heteroproteínas o conjugadas: tal como lo dicta su nombre, se trata de la conjugación de una proteína con un grupo no proteico que lleva por nombre grupo prostético. Dependiendo de la unión del grupo prostético se clasifican en varios tipos: glicoproteínas, lipoproteínas, nucleoproteínas y cromoproteínas. Algunos ejemplos son la hemoglobina, el citocromo y la ribonucleasa.
Alimentos con proteínas
Una alimentación saludable viene acompañada de una ingesta suficiente de proteínas, de esta manera se obtienen los aminoácidos esenciales para la síntesis y creación de proteínas necesarias para el cuerpo. Para obtener una dieta sana y que involucre a todos los aminoácidos requeridos por el organismo, se recomienda alimentarse tanto de productos de origen animal así como de vegetales.
El consumo de proteínas a través de los alimentos es realmente importante, ya que los organismos no sintetizan todos los aminoácidos esenciales requeridos para su desarrollo. Por lo tanto, debe obtenerse a través de la ingesta de alimentos ricos en esta biomolécula. Algunos de los alimentos con mayor porcentaje de esta macromolécula en su constitución son los siguientes:
Origen animal: huevos, carne (pollo, res, pescado, cerdo, conejos, etc.), también incluye derivados lácteos como el queso, mantequilla. Se debe tener en cuenta que algunos alimentos ricos en proteínas también pueden estar acompañados de otros compuestos como las grasas, por lo que se debe escoger entre los más saludables.
Origen vegetal: en los vegetales también encontramos alimentos con gran aporte proteico, y que son indispensables en dietas vegetarianas. Entre los alimentos vegetales con mayor aporte proteico están: la soya, trigo, legumbres de diferentes tipos como las lentejas y frijoles, también los frutos secos.
Referencias
– Fleming, P. & Rose, G. (2005) Do all backbone polar groups in proteins form hydrogen bonds? Prot Sci; 14: 1911–1917. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2253345/
– González-Torres, L.; Tellez-Valencia, A.; Sampedro, J.; Nájera, H. (2007). Las proteínas en la nutrición. Revista de Salud Pública y Nutrición; 8(2).
– Keservani, R.; Sharma, A.; Jarouliya, A. (2015). Protein and Peptide in Drug Targeting and its Therapeutic Approach. Ars Pharmaceutica; 56(3): 165-177. https://scielo.isciii.es/pdf/ars/v56n3/especial.pdf
– Santos, J. (2009). Proteínas estructuras fascinantes. Primera edición. Ministerio de Educación de la Nación. Instituto Nacional de Educación Tecnológica. Buenos Aires, República Argentina.
– Yon, J. (2001). Protein folding: a perspective for biology, medicine and biotechnology. Brazilian Journal of Medical and Biological Research; 34: 419-435. http://www.scielo.org.co/pdf/bjmbr/v34n4/3930.pdf