Índice de este artículo
Todas las células mantienen una interacción con el medio exterior, quien puede estar compuesto por una serie de soluciones de diversas características. Una de ellas son las soluciones isotónicas, cuya composición es de gran interés para el mantenimiento de los procesos osmóticos y la integridad celular. Estas soluciones tienen un efecto directo mediante la difusión pasiva que puede alterar la concentración de solutos al interior de los cuerpos celulares.
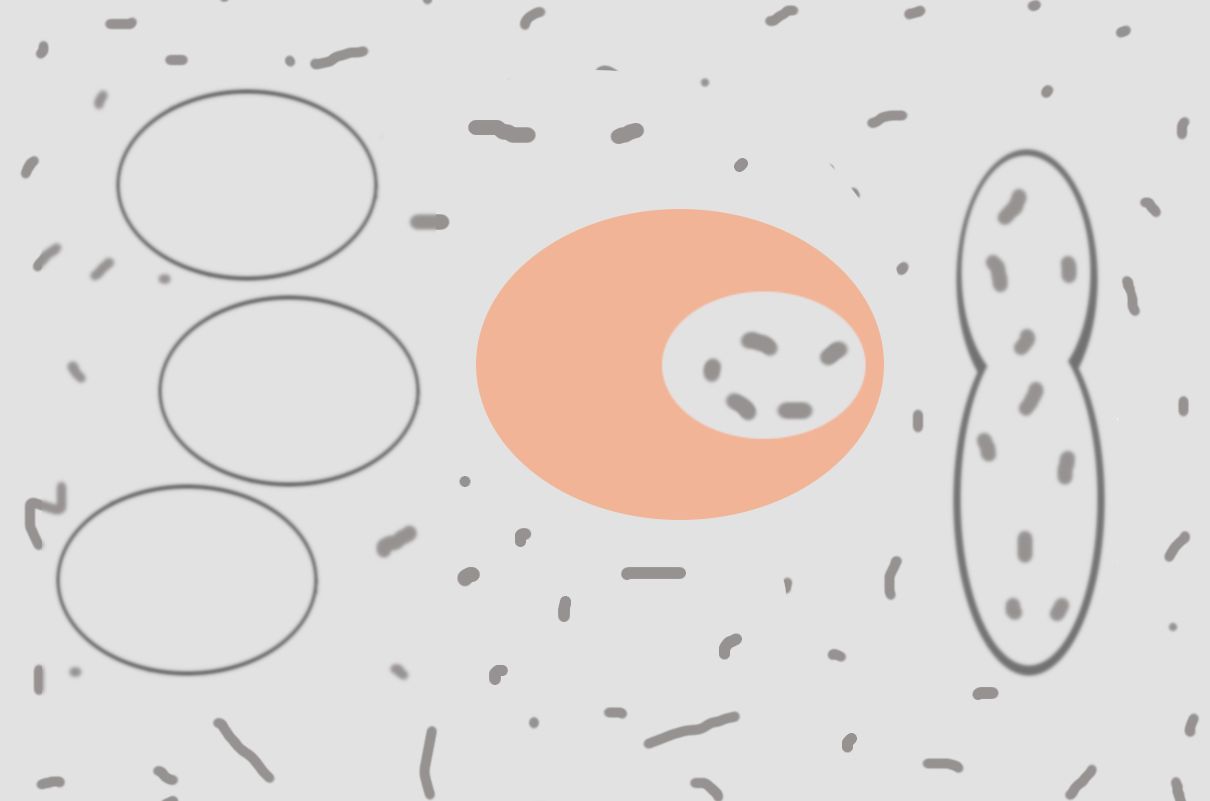
Las soluciones isotónicas permiten mantener un equilibrio osmótico, lo que influye de manera positiva en el funcionamiento y en la conservación de los procesos fisiológicos y metabólicos de las células En este artículo abordaremos todas las características de las soluciones isotónicas, cómo afectan la integridad celular, algunos usos y ejemplos.
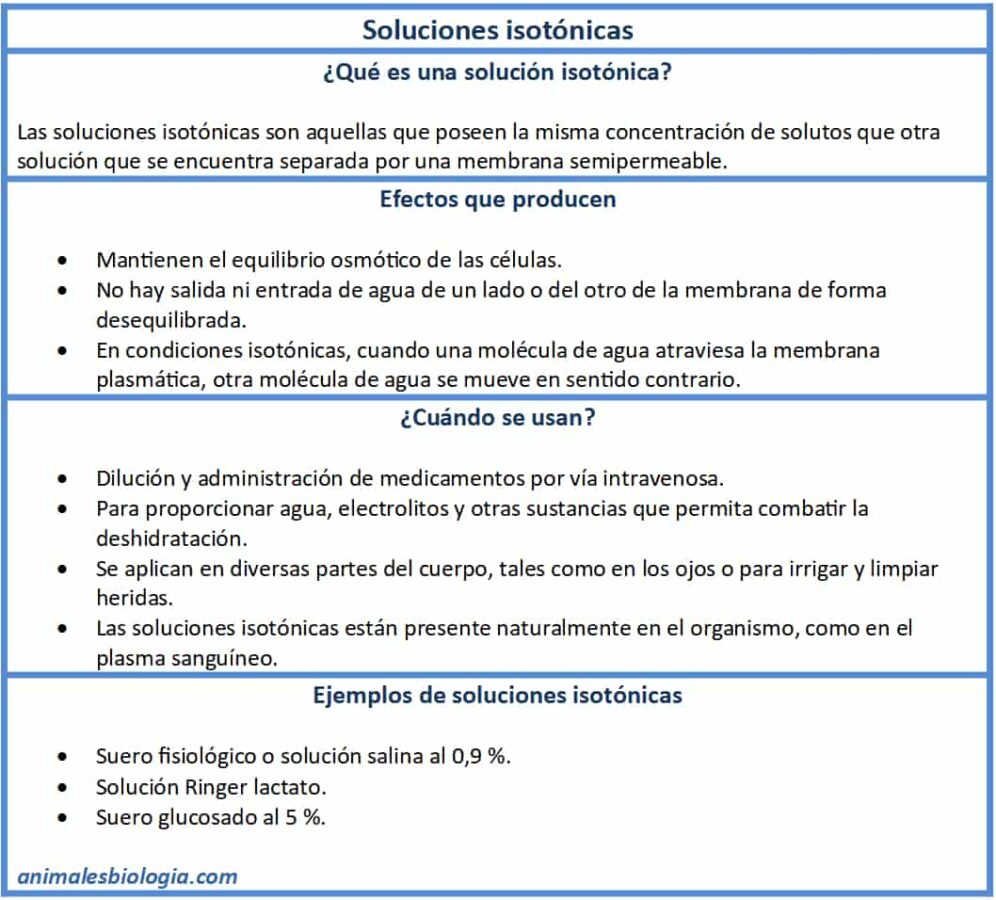
¿Qué son las soluciones isotónicas?
Cuando dos soluciones se encuentran separadas mediante una membrana semipermeable, y la concentración de soluto en ambas es idéntica, se identifica como una solución isotónica. La membrana que separa a ambas soluciones solo deja pasar a través de sus poros de manera pasiva al solvente.
En términos biológicos, se puede ejemplificar con las células, estas unidades están rodeadas por la membrana plasmática que es una membrana semipermeable natural. La solución que se encuentra dentro de ella (fluido intracelular), posee la misma concentración de solutos que la solución que las rodea (fluido extracelular). En este caso, la solución extracelular es la que se identificará como solución isotónica.
Mecanismo de acción
A diferencia de otros tipos de soluciones, como la hipertónica o las hipotónicas, las soluciones isotónicas no ejercen efecto alguno sobre la presión osmótica de las células, sino más bien, mantienen el equilibrio entre el medio intracelular con el extracelular.
Cuando las soluciones isotónicas están en contacto con las membranas semipermeables, no existe un flujo de entrada o salida de agua hacia un lado u otro de la misma, sino que se cumple con el principio si sale una molécula de agua, entra otra al mismo tiempo.
¿Cuándo se usan?
El equilibrio osmótico entre los fluidos intracelulares y extracelulares es de gran importancia para el funcionamiento de los organismos vivos, por lo que mantenerlo es una tarea que las soluciones isotónicas deben cumplir. En ciertas ocasiones es posible que este equilibrio se vea afectado, por lo que es necesario reponer las concentraciones mediante el uso de soluciones preparadas para tal fin.
Como ya se ha mencionado las soluciones isotónicas tienen un papel fundamental en el mantenimiento de los procesos fisiológicos y metabólicos de las células. Por lo tanto, es importante conocer los procesos en que dichas soluciones son utilizadas para mantener el equilibrio osmótico.
– Un uso particular que se les da es para la aplicación de medicamentos por la vía intravenosa, la solución que se utiliza para diluir y transportar el medicamento, por lo general, es de índole isotónica. De esta manera, se reducen los riesgos de daños y pérdida de propiedades a las células, lo que podría derivar en la muerte de la misma.
– Durante cualquier evento que estrese a las células, como la pérdida de electrolitos por acción de deshidratación por alguna enfermedad o realizar esfuerzo físico, se altera de manera significativa la concentración de los fluidos intra y extracelulares. Para reponer el equilibrio se emplean soluciones isotónicas o lo que se conoce de forma común suero fisiológico, el cual contribuye a restablecer los valores de los solventes o los líquidos de los organismos.
– La implementación de estas soluciones no es solamente intravenoso, sino que abarca a cualquier fluido del organismo. De manera que para implementarlas se estudia primero la composición del fluido al que irá dirigido, ejemplo de ello son las soluciones o medicamentos que se aplican en los ojos. También para irrigar y limpiar heridas.
– De manera natural también se encuentran soluciones isotónicas en los organismos, esto previene que las células que conforman un tejido puedan verse afectadas. El ejemplo común para ello es el plasma sanguíneo, el cual presenta sales e iones en la misma concentración que el interior de los glóbulos rojos y blancos, evitando que estos puedan deformarse y dejar de cumplir su función.
Ejemplo de soluciones isotónicas
Para disminuir los daños que pueden sufrir las células ante un evento que comprometa su estabilidad osmótica, se han creado una serie de soluciones que cumplen con las características isotónicas, de manera que se puedan recuperar y restablecer el equilibrio osmótico en ellas. Algunos ejemplos son los siguientes:
– Suero fisiológico: también conocido como solución salina, tienen una composición de 0,9 % de cloruro de sodio en agua. Esta solución isotónica está diseñada para combatir los procesos de deshidratación o la pérdida de sodio en el cuerpo, la cual puede ser provocada por varias causas entre ellas enfermedades, fiebre alta o tras una intervención quirúrgica. De igual manera, es usada para irrigar y limpiar heridas en cualquier parte del cuerpo. Así como también, es la solución más empleada para la administración de medicamentos intravenosos.
– Solución Ringer lactato: con una concentración menor de cloro que la solución fisiológica, el Ringer, es considerado una solución isotónica. Está compuesto además del lactato por electrolitos como sodio, potasio y calcio. Su uso es frecuente cuando ocurren deshidrataciones con pérdida de electrolitos, para la reposición del fluido plasmático entre otras.
– Suero glucosado al 5 %: como su nombre lo indica es una solución que contiene en su composición 5 % de glucosa, siendo utilizada para restablecer la hidratación perdida por la sudoración u otros particulares como la falta de ingesta líquida. Además, la glucosa aporta la energía necesaria para cumplir con los procesos metabólicos.
Referencias
– Crawford, A. & Harris, H. (2011). Equilibrio entre sodio y potasio. Nursing, 29 (9): 14-20.
– García, J. & Ardila, A. (2009). La variación del volumen celular bajo diferentes concentraciones de solución salina (NaCL). Revista Colombiana de Anestesiología; 37(2): 101-109.
– Píriz, N.; López, M.; Tucci, J.; Cantero, J.; Mallarini, V. (2019). Tonicidad: ¿una propiedad de las soluciones y/o de las células? aprendizaje sustentable del transporte de agua. Bio-grafía. Escritos sobre la Biología y su enseñanza; 11(22): 21–30. https://revistas.pedagogica.edu.co/index.php/bio-grafia/article/view/8587
– Tiskow, G. (2006). El fenómeno de la ósmosis. Serie de cuadernos, lecciones básicas de fisiología. Universidad Centroocidental Lisandro Alvarado. 54 páginas.