Índice de este artículo
Desde la antigüedad se ha tratado de estudiar la composición de la materia, es decir, de investigar los componentes e integrantes mínimos de todo aquello que ocupa un lugar en el espacio. Durante estos estudios se han propuestos diversas teorías, tratando de explicar el origen y la constitución de estos constituyentes químicos, llegando a lo que se conoce hoy como el átomo.
Átomo ¿Qué es?
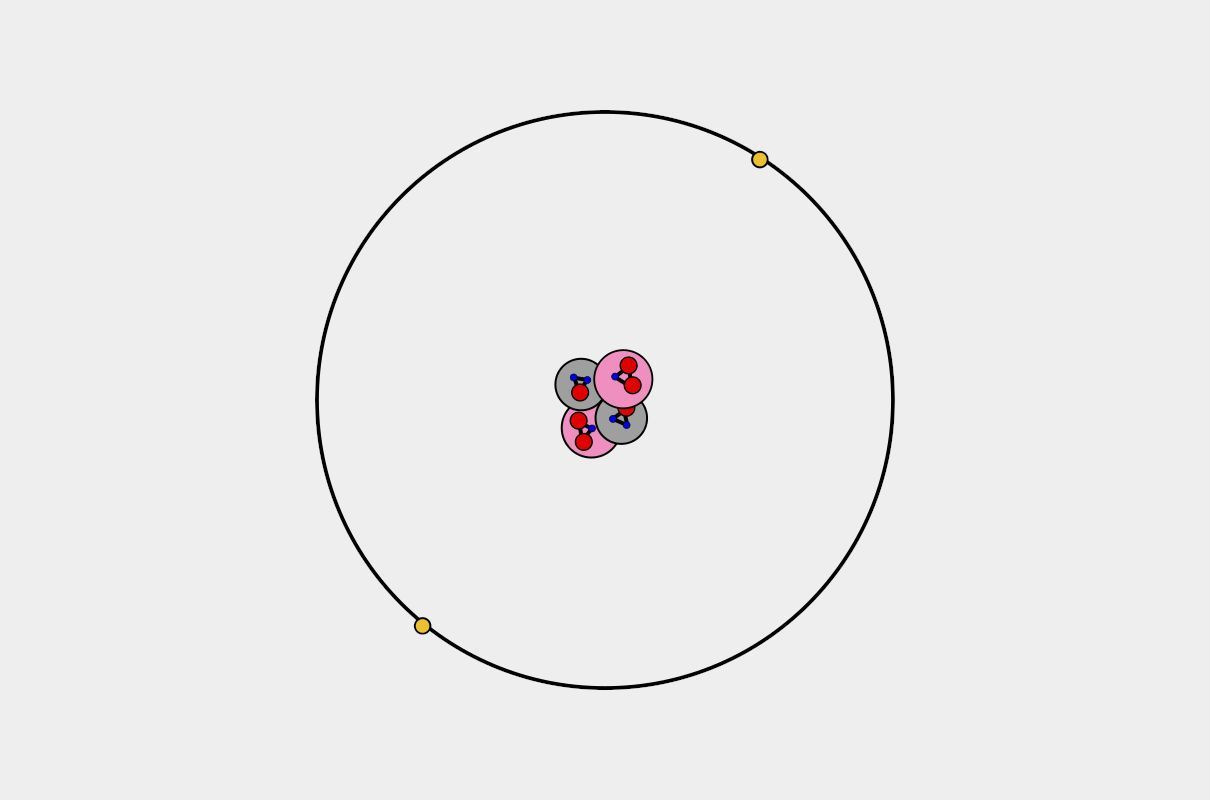
La definición del átomo ha traído bastante controversia a través de los años, actualmente se considera como la partícula o porción de menor tamaño que conforma un elemento químico, el cual a su vez le dará forma a la materia, por lo que cada estado de la materia sólido, líquido, gaseoso y plasma está compuesto por átomos. A pesar de que es un compuesto de pequeño tamaño, este posee todas las características y propiedades del elemento, por este hecho puede combinarse bien sea con sus iguales, es decir, átomos de la misma naturaleza para conformar compuestos puros o con átomos diferentes para conformar elementos combinados.
De igual forma en épocas anteriores se creía que al ser el componente más pequeño de la materia, este no podía dividirse en elementos más pequeños, teoría que se revocó con experimentos en donde se pudo observar que el átomo está conformado por diferentes partículas que veremos más adelante. El nombre de átomo proviene de esta teoría, en la que no puede dividirse, la palabra átomo posee una larga historia y proviene del latín “atomum”, la cual a su vez proviene del griego antiguo “a” que significa sin y “tomon” que significa corte, dándole sentido a la palabra sin cortar o que no se puede dividir.
Estructura y partes del átomo
El átomo lo integran dos partes fundamentales que se denominan núcleo y corteza, en la cual hay diferentes partículas que lo constituyen. Durante el estudio de la teoría atómica se ha dado a conocer que el núcleo se encuentra situado en el centro y es la parte que presenta el mayor peso de la estructura, en el núcleo se encuentran partículas subatómicas (como protones y neutrones), así mismo en la corteza se pueden localizar aquellas de menor peso entre las que se encuentran los electrones.
La estructura del átomo y como este se representa en el espacio ha sufrido varias modificaciones, por lo que a medida que se va mejorando la tecnología para la captación de sus componentes se van modificando, para así realizar un modelo mucho más estable. Las teorías atómicas más importantes que se han desarrollado comienza con John Dalton en el año 1803, seguidamente y mejorar esta teoría lo consigue el británico Thomson, luego está el modelo atómico propuesto por el investigador Rutherford en 1911 y finalmente los trabajos importantes de Bohr para el año 1913 en la que establece la teoría de las órbitas cuantificadas.
Cómo está formado el átomo
Como ya lo hemos mencionado es una partícula que sí puede dividirse en otras más pequeñas, llamadas partículas subatómicas, entre éstas se encuentran el protón, el neutrón y el electrón.
Protón
Es una de las partículas que conforman el núcleo, entre las características más importantes podemos mencionar que presentan carga positiva, es una de las partículas con mayor masa 1.674 x 10-27 kg, muy parecida a la del neutrón y junto a este conforman casi todo el peso del átomo. El protón es una partícula estable y tiene un rol fundamental en la estructura del átomo, ya que el número de protones que lo conforman dará lugar al número atómico que a su vez rige las propiedades químicas que pueda tener dicho átomo, otro factor fundamental de los protones es que al poseer la carga positiva es el encargado de atraer a los electrones.
Neutrones
Junto con los protones, los neutrones se encuentran en el núcleo, esta partícula presenta una masa que supera por poco al del protón 1,675×10−27 kg, su característica principal es que su carga es neutra, es decir, 0, por lo que su nombre proviene de allí. Su descubrimiento oficial data del año 1932 por el físico J. Chadwick, esta partícula no tiene incidencia directa sobre las propiedades químicas, pero sí ayuda a mantener la estabilidad del núcleo.
Electrones
Son las partículas que conforman la corteza, su carga es negativa y posee una masa muy inferior a la de los protones y neutrones ( 9.11 x 10-31 kg), por lo que no representa un gran porcentaje en el peso total del átomo considerándose como depreciable. El descubrimiento del electrón se le da al físico Joseph John Thomson, con su experimento de rayos catódicos. Los electrones no siempre están unidos en un átomo atraído por los protones, también se pueden encontrar libres e intercambiarse entre un átomo y otro.
Otras partículas elementales del átomo
Con posterioridad al descubrimiento de las partículas subatómicas en la que se comprobó que el átomo si podía dividirse en partículas más pequeñas, siguieron los esfuerzos para tratar de llegar a los componentes más básicos de la materia, lográndose descubrir otras partículas clasificándolas en función de su masa, entre ellas tenemos las siguientes:
Los leptones: se consideran los componentes más ligeros, estando entre ellos el electrón, el neutrino, el muón y el leptón tau.
Los mesones: estas partículas poseen una masa media entre los representantes de este grupo el mesón o pion y el kaón entre otros.
Los bariones: son partículas que poseen una mayor masa, siendo los más representativos el protón y el neutrón, pero se han descubierto muchas otras partículas elementales como lambda, sima y delta.
Autores consultados
- Federación de Enseñanza de CC.OO. de Andalucía. (2011).
- Garrigo, C. (2008).
- Perea, J. (1995).
- Planas, O. (2019).
- Ynduráin, F. (2000).
Otros temas de ciencias naturales: Eras geológicas de la Tierra.






Deja una respuesta