Índice de este artículo
Todos los seres vivos están constituidos por átomos de diversos elementos químicos presentes en la naturaleza, por lo tanto, hay una interacción constante entre ellos. Dicha interacción se logra mediante la creación de enlaces químicos que permite unir a estos átomos, bien sea temporalmente o de manera estable en el tiempo. Conocer los tipos de enlaces y su importancia biológica, permite comprender como estas uniones de átomos dan forma y contribuyen a mantener las funciones de todo tipo en los seres bióticos.
Los tipos de enlaces que existen son variados, cada uno con características distintivas que cumplen una función en particular generando consecuencias a nivel biológico. En este texto detallaremos qué son los enlaces químicos y cómo las interacciones que se producen influyen en los seres vivos, además de nombrar ejemplos de ellos.
¿Qué son los enlaces químicos?
Todas las moléculas incluyendo las que conforman a los seres vivos, están compuestas por átomos de diferentes elementos químicos, estas partículas atómicas no se unen por asar, sino que corresponden a una serie de eventos y fuerzas que permiten la interacción de una manera estable. Entonces, por enlaces químicos se entiende como el vínculo o la fuerza que mantienen una unión estable entre los átomos que conforman una molécula.
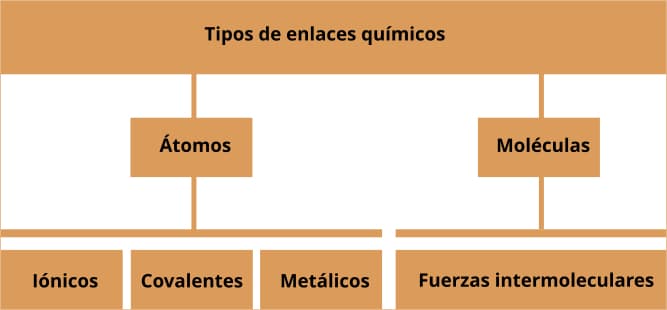
Los diferentes tipos de enlaces químicos se pueden dar entre átomos para formar moléculas o entre las moléculas para configurar estructuras más complejas (macromoléculas). La interacción que ocurre entre estas partículas sucede a nivel de los electrones, los cuales serán redistribuidos cediendo, ganando o compartiendo, de manera que alcanzan el nivel más bajo y estable de energía, procurando cumplir con la ley del octeto.
Ley del octeto: esta ley establece que cuando los átomos se unen, intentan buscar la estabilidad energética mediante la redistribución de sus electrones, siempre procurando tener la configuración de los gases nobles que en su última capa electrónica poseen 8 electrones.
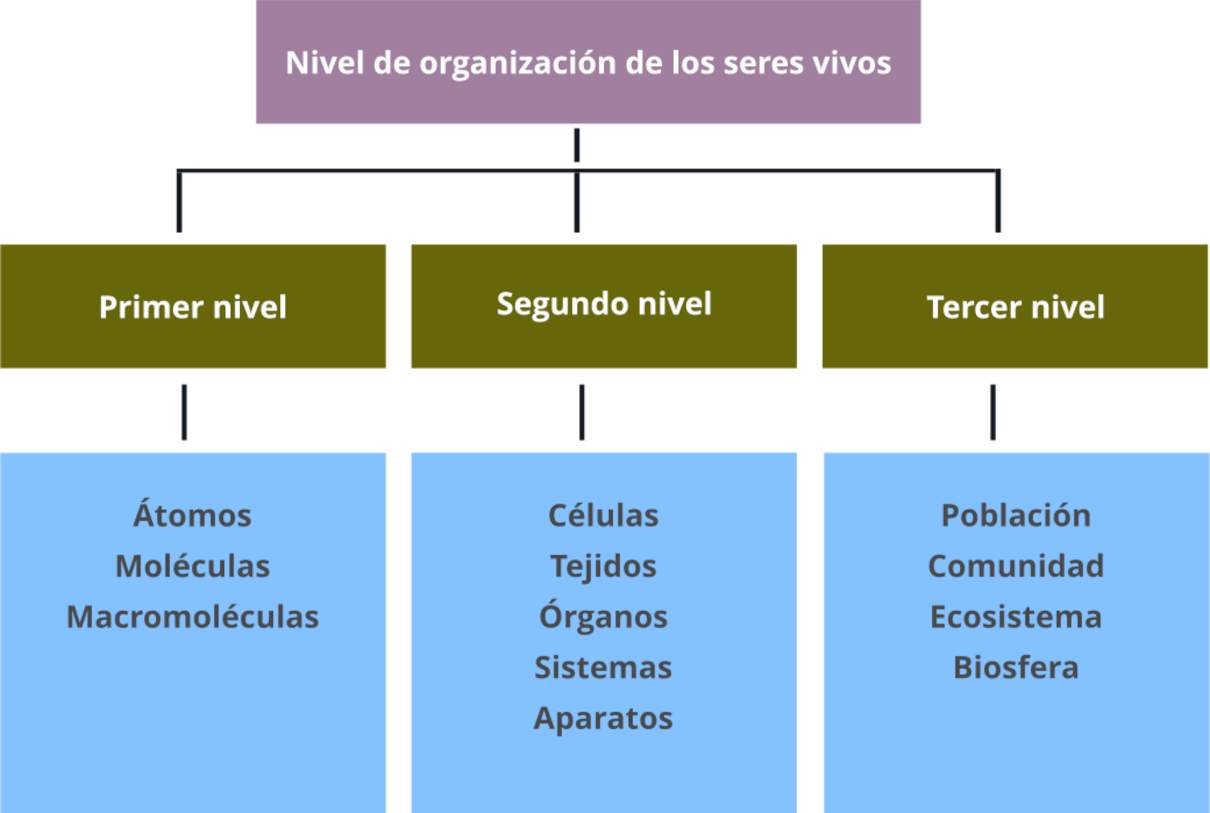
Tipos de enlaces químicos
Enlaces iónicos
También llamado enlaces electrovalentes, se trata de la forma más simple de unión entre los átomos. Este enlace sucede por la interacción entre las partículas atómicas con cargas eléctricas. Estos átomos reciben el nombre de iones y pueden tener cargas positivas (cationes) como negativas (aniones).
Los iones pueden ser átomos individuales de algún elemento o moléculas que han perdido o ganado electrones. De forma general, los enlaces iónicos ocurren entre elementos metálicos y no metálicos. En este sentido los elementos metálicos son los que tiende a perder electrones quedando así cargados positivamente (se forma un catión), mientras que los no metales ganan electrones por lo que su carga es negativa (forman un anión).
Enlaces covalentes
En las moléculas que conforman los seres vivos hay todo tipo de enlaces, pero los más abundantes son los covalentes. Estos se refieren cuando los átomos en vez de ceder o ganar electrones los comparten, por lo tanto, las moléculas resultantes no poseen carga positiva o negativa, sino que son neutros.
Los elementos que producen enlaces covalentes durante su unión son los no metálicos, cuya diferencia de electronegatividad es mínima. Dependiendo del tipo de molécula que se forme y la cantidad de electrones que comparten cada átomo, se puede generar más de un enlace covalente quedando clasificados de la siguiente manera:
– Enlaces simples: se forman cuando los átomos comparten un solo electrón cada uno de su capa de valencia.
– Enlaces dobles: los átomos que se unen comparten dos electrones de su capa de valencia.
– Enlaces triples: siguiendo el mismo patrón, los átomos que interactúan comparten tres electrones.
De igual manera, dentro de los enlaces covalentes existe una clasificación atendiendo a su naturaleza polar o apolar.
Enlaces covalentes polares: son aquellos donde los elementos que se unen son distintos. Además, se caracterizan porque uno de ellos es más electronegativo, es decir, tiene una atracción superior por los electrones. Esto da como resultado la formación de polos en la molécula, donde uno de sus polos es más negativo por la presencia de electrones y el otro queda positivo. Ejemplo de ello es la molécula del agua (H2O).
Enlaces covalentes apolares: las moléculas que participan en la interacción están formadas por los mismos átomos, por lo tanto, comparten sus electrones de la misma manera y no se forman polaridades. Ejemplo de estos enlaces lo conforman las moléculas de oxígeno (O2) e hidrógeno (H2).
Enlaces metálicos
Es un tipo de enlace fuerte entre átomos metálicos de un mismo elemento, la atracción que ocurre entre los núcleos positivos de estos elementos permite su empaquetamiento, dejando libre a los electrones quienes se mantienen alrededor de ellos como una nube o le que se conoce como un mar de electrones. Ejemplo de este tipo de enlace lo realizan elementos como el oro, plata, cobre, hierro, aluminio.
Fuerzas intermoleculares
Considerados de los enlaces más débiles pero de gran importancia, entre ellos se destacan las fuerzas dipolo-dipolo y los puentes de hidrógeno.
Fuerzas dipolo-dipolo: sucede entre moléculas polares, donde existe una asimetría en la distribución electrónica. En este caso, donde las moléculas tienen un polo positivo y uno negativo, y cuando interaccionan con otra molécula polar, sus polos se atraen con su contraparte positiva o negativa, respectivamente.
Puentes de hidrógeno: considerado como un tipo de interacción dipolo-dipolo, son enlaces que ocurren cuando un átomo de hidrógeno esta enlazado de manera covalente a una molécula de gran electronegatividad, lo que atrae a otra molécula de igual característica electronegativa. Estos puentes de hidrógeno suceden entre moléculas diferentes (enlaces intermoleculares), como dentro de una misma molécula (enlaces intramoleculares).
Importancia biológica de los enlaces químicos
Los tipos de enlaces se establecen por la acción que tienen las moléculas que se forman cuando los átomos se unen a través de dichos enlaces. Los enlaces químicos unen desde dos átomos hasta miles de ellos para conformar biomoléculas funcionales, estas biomoléculas pueden ser de naturaleza orgánica e inorgánica.
Los enlaces iónicos que conforman sales minerales como carbonato de calcio, cloruro de sodio, también son importantes, ya que muchos de los iones que intervienen en estos enlaces son parte de los electrolitos que necesitan los cuerpos para el funcionamiento fisiológico. Así mismo, forman compuestos esenciales para otros seres vivos como lo son los fertilizantes, entre ellos los nitratos.
Por su parte, los enlaces covalentes están presentes en las biomoléculas tanto orgánicas como inorgánicas, forman moléculas indispensables como el agua y el oxígeno. Entre las biomoléculas orgánicas que presentan enlaces covalentes están los glúcidos, lípidos y proteínas.
No menos resaltantes entre los tipos de enlaces son las fuerzas intermoleculares, quienes están presente en las biomoléculas orgánicas realizando un trabajo fundamental de plegamiento, lo que le proporciona identidad a cada molécula para realizar una función específica. Estas fuerzas son muy comunes en los aminoácidos y las proteínas.

Referencias
– Cárdenas, J. & Narváez, L. (2018). El enlace covalente. Entornos; 31(1): 221-228.
– López, M. (2017). Enlaces químicos, fuerzas intermoleculares y su relación con Ciencias de la Tierra. Universidad Nacional Autónoma de México. Facultad de Ingeniería. http://www.ptolomeo.unam.mx:8080/jspui/bitstream/132.248.52.100/14231/4/Enlaces%20qu%C3%ADmicos%20fuerzas%20intermoleculares%20y%20su%20relaci%C3%B3n%20con%20Ciencias%20de%20la%20Tierra.pdf
– Pozas, A.; Martín, R.; Rodríguez, A.; Ruíz, A.; Vasco, A. (2016). Química. 2 ° bachillerato. Mc Graw Hill Education. Andalucía.
– Raymond, Chang, (2006). Química general para bachillerato. Mc Graw Hill. China.
– Salas-Banuet, G. & Ramírez-Vieyra, J. (2010). Iónico, covalente y metálico. Educación química; 21(2), 118-125. http://www.scielo.org.mx/pdf/eq/v21n2/v21n2a3.pdf